Pharmakodynamik beschreibt, was ein Arzneimittel im Körper bewirkt. Während die Pharmakokinetik erklärt, wie ein Wirkstoff aufgenommen, verteilt, metabolisiert und ausgeschieden wird, beantwortet die Pharmakodynamik die Frage, welche Effekte ein Wirkstoff auslöst, sobald er sein Ziel erreicht. Sie untersucht, wie Arzneimittel an Rezeptoren, Enzyme, Ionenkanäle oder Transportproteine binden und welche biologischen Reaktionen daraus entstehen.
Dieser Artikel gibt einen verständlichen Überblick über zentrale Konzepte der Pharmakodynamik. Er erläutert, wie Wirkstoffe Zielstrukturen aktivieren oder blockieren, wie sich die Wirkung mit der Dosis beziehungsweise Konzentration verändert und welche Parameter dabei wichtig sind. Außerdem zeigt er, warum Menschen unterschiedlich auf dieselbe Substanz reagieren und welche pharmakodynamischen Grundlagen für die sichere Anwendung von Arzneimitteln relevant sind.
Pharmakodynamik Definition
Pharmakodynamik umfasst die biologischen Prozesse, durch die ein Arzneimittel eine Wirkung auslöst. Dazu gehört die Interaktion eines Wirkstoffs mit Zielstrukturen wie Rezeptoren, Enzymen, Ionenkanälen oder Transportproteinen sowie die Weiterleitung der dadurch ausgelösten Signale in der Zelle und im Gewebe. Diese Mechanismen bestimmen, welche Effekte auftreten, wie stark sie ausfallen und welche therapeutischen oder unerwünschten Wirkungen entstehen können.
Im Zentrum steht der Zusammenhang zwischen der Konzentration am Wirkort und der Stärke der Wirkung. In der Praxis wird häufig die Konzentration im Blut oder Plasma als Näherung verwendet, weil die Konzentration am Wirkort nicht immer direkt messbar ist.
Pharmakodynamik einfach erklärt
Pharmakodynamik lässt sich gut an zwei typischen Wirkprinzipien verdeutlichen.
Ein opioidhaltiges Schmerzmittel wie Morphin bindet an Opioidrezeptoren im Nervensystem, die auch durch körpereigene Botenstoffe wie Endorphine aktiviert werden. Durch die Rezeptoraktivierung werden Signalwege beeinflusst, die die Weiterleitung von Schmerzreizen hemmen. Schmerzsignale werden dadurch weniger stark verarbeitet und die betroffene Person nimmt den Schmerz abgeschwächt wahr. Vereinfacht gesagt verstärkt Morphin ein körpereigenes schmerzhemmendes System.
Ein anderes Prinzip zeigt sich bei Betablockern, die unter anderem bei Hypertonie eingesetzt werden. Sie binden an Beta-Rezeptoren, lösen dort aber keine Aktivierung aus, sondern blockieren die Wirkung körpereigener Stresshormone wie Adrenalin und Noradrenalin. Dadurch werden Herzfrequenz und Kontraktionskraft gedämpft, was den Blutdruck senken kann.
Diese Beispiele zeigen die Grundidee der Pharmakodynamik: Wirkstoffe verändern biologische Prozesse, indem sie Zielstrukturen aktivieren, hemmen oder modulieren.
Zentrale Konzepte der Pharmakodynamik
Im Zentrum der Pharmakodynamik stehen die Zielstrukturen, an die ein Wirkstoff bindet, und die Mechanismen, durch die diese Bindung eine Wirkung auslöst oder abschwächt.
Arzneimittel können an Rezeptoren ansetzen, die Signale in Zellen übertragen, an Enzymen, die biochemische Reaktionen katalysieren, sowie an Transportproteinen und Ionenkanälen, die Stoffe oder elektrische Signale durch Zellmembranen bewegen. Welche Struktur beeinflusst wird, bestimmt maßgeblich, welche Wirkung entstehen kann.
Agonisten und partielle Agonisten
Ein Agonist bindet an einen Rezeptor und aktiviert ihn. Er imitiert damit den natürlichen Botenstoff und löst eine Rezeptorantwort aus. Morphin wirkt in diesem Sinn als Agonist an Opioidrezeptoren und verstärkt schmerzhemmende Signalwege.
Ein partieller Agonist bindet ebenfalls an den Rezeptor, aktiviert ihn aber nur teilweise. Selbst bei hoher Dosis bleibt die maximale Wirkung begrenzt, weil der Rezeptor nicht vollständig aktiviert wird. Das ist klinisch relevant, weil partielle Agonisten in manchen Situationen stabilisierend wirken können, etwa indem sie starke Überaktivierungen begrenzen.
Antagonisten und funktionelle Blockaden
Antagonisten binden an einen Rezeptor, ohne ihn zu aktivieren. Sie blockieren den Rezeptor und verhindern dadurch die Wirkung des natürlichen Botenstoffs. Betablocker sind ein typisches Beispiel, häufig als kompetitive Antagonisten an Beta-Rezeptoren.
Ein ähnliches Prinzip gibt es bei Ionenkanälen oder Transportproteinen. Wenn ein Kanal blockiert wird, verändert sich der Fluss von Ionen und damit die elektrische Erregbarkeit von Zellen. Dadurch lassen sich überaktive Prozesse gezielt dämpfen.
Enzymhemmung, Transportermodulation und physikalisch-chemische Mechanismen
Viele Arzneimittel wirken über Enzyme. Enzyme können reversibel oder irreversibel gehemmt werden, entweder durch Bindung am aktiven Zentrum oder an einer anderen Bindestelle, die die Aktivität indirekt beeinflusst. Das Ergebnis ist eine verringerte Bildung oder ein verringerter Abbau bestimmter Signalstoffe.
Ein wichtiges Beispiel sind Protonenpumpenhemmer. Sie hemmen die H+/K+-ATPase der Belegzellen und reduzieren dadurch die Magensäuresekretion deutlich. Bei vielen Wirkstoffen dieser Klasse spielt eine irreversible Hemmung nach Aktivierung im sauren Milieu eine zentrale Rolle.
Transportproteine und Ionenkanäle können ebenfalls moduliert werden. Wenn ein Wirkstoff ihre Funktion verändert, beeinflusst er den Transport von Botenstoffen oder Ionen und damit die Stärke nachgeschalteter Signale.
Manche Arzneimittel wirken zusätzlich physikalisch oder chemisch, etwa Antazida, die Magensäure neutralisieren. Solche Effekte ergänzen die klassischen rezeptorvermittelten Wirkungen.
Pharmakodynamische Variabilität
Menschen reagieren unterschiedlich stark auf denselben Wirkstoff. Diese Unterschiede entstehen nicht nur durch pharmakokinetische Faktoren, sondern auch durch Eigenschaften des Zielsystems, an dem ein Arzneimittel wirkt.
Rezeptordichte und Rezeptorempfindlichkeit
- Rezeptordichte: Die Anzahl verfügbarer Rezeptoren kann beeinflussen, wie stark ein System auf einen Wirkstoff reagiert und welche maximale Wirkung erreichbar ist. Bei chronischer Stimulation kann die Rezeptorzahl abnehmen (Downregulation), was eine Toleranz begünstigen kann.
- Rezeptorempfindlichkeit: Veränderungen der Rezeptorfunktion oder der nachgeschalteten Signalübertragung können die Wirkung verstärken oder abschwächen.
Genetische Unterschiede
Genetische Varianten können die Eigenschaften von Rezeptoren, Enzymen oder Transportproteinen verändern. Schon kleine strukturelle Unterschiede können beeinflussen, wie stark ein Wirkstoff bindet oder wie effizient ein Signal ausgelöst wird. Auch die Stärke nachgeschalteter Signalwege kann zwischen Personen variieren. Das trägt zur interindividuellen Unterschiedlichkeit der Arzneimittelwirkung bei.
Pathophysiologische Faktoren
Erkrankungen können Rezeptorzahl, Signalwege oder Homöostase verändern und damit die Wirkung eines Arzneimittels verstärken oder abschwächen. Entzündungen, Hormonstörungen oder Veränderungen des Elektrolythaushalts beeinflussen ebenfalls die Empfindlichkeit pharmakodynamischer Systeme.
Pharmakodynamische Wechselwirkungen
- Wirkungsverstärkung: Wenn zwei Arzneimittel am selben System wirken, kann sich die Gesamtwirkung addieren oder überadditiv verstärken.
- Abschwächung: Agonist und Antagonist am selben Rezeptor können sich teilweise oder vollständig aufheben.
- Signalwegmodulation: Arzneimittel können sich indirekt beeinflussen, indem sie gemeinsame Signalwege verstärken oder dämpfen.
Die Dosis-Wirkungs-Beziehung in der Pharmakodynamik
Die Wirkung eines Arzneimittels hängt davon ab, wie viele Zielstrukturen erreicht werden und wie stark diese aktiviert oder gehemmt werden. Die Dosis-Wirkungs-Beziehung beschreibt, wie die Stärke eines Effekts mit zunehmender Dosis beziehungsweise Konzentration zunimmt und wo Grenzen durch Sättigung oder maximale Systemantwort liegen.
Grundprinzip der Dosis-Wirkungs-Kurve
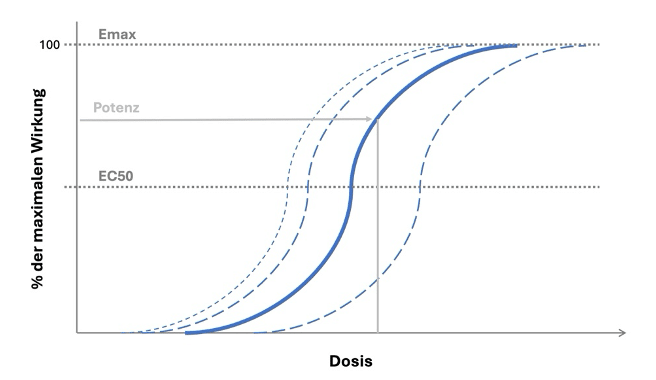
Mit steigender Konzentration bindet ein Wirkstoff an mehr Zielstrukturen und die Wirkung nimmt zu. Diese Zunahme ist meist nicht linear. Häufig zeigt sich eine Sättigung bis hin zu einem Plateau, wenn das System maximal reagiert oder alle relevanten Zielstrukturen besetzt sind.
Oft wird der Effekt gegen die logarithmierte Konzentration aufgetragen, wodurch die charakteristische S-Form der Kurve besonders gut sichtbar wird. Pharmakodynamisch relevant ist die Konzentration am Wirkort; in Studien und in der Praxis wird jedoch häufig die Blut- oder Plasmakonzentration als Näherung verwendet. Die Verknüpfung von Konzentration und messbarem Effekt ermöglicht die Bestimmung zentraler Kenngrößen wie EC50 und Emax.
Die hier beschriebene Dosis-Wirkungs-Beziehung ist ein zentrales Element der PK/PD-Modellierung, mit der zeitliche Konzentrationsverläufe und pharmakodynamische Effekte gemeinsam analysiert werden.
Parameter der Dosis-Wirkungs-Beziehung
- EC50: Konzentration, die erforderlich ist, um 50 Prozent der maximalen Wirkung zu erreichen. Ein niedriger EC50-Wert spricht für hohe Potenz.
- Emax: maximal erreichbare Wirkung. Sie hängt vom Wirkstoff und vom Zielsystem ab, etwa von Rezeptorzahl und Signalweiterleitung.
- Potenz: Maß dafür, welche Konzentration für einen bestimmten Effekt nötig ist. Potenz wird häufig über EC50 beschrieben.
- Wirksamkeit: beschreibt, wie groß die maximal mögliche Wirkung ist, unabhängig davon, welche Dosis dafür nötig ist. Sie orientiert sich an Emax.
Diese Parameter helfen einzuschätzen, welche Dosis erforderlich ist, um einen gewünschten Effekt zu erreichen, und wie gut sich Wirkstoffe miteinander vergleichen lassen.
Klinische Bedeutung pharmakodynamischer Zusammenhänge
Pharmakodynamische Prozesse bestimmen nicht nur Stärke und Richtung einer Wirkung, sondern auch die Sicherheit eines Arzneimittels in der Anwendung.
Therapeutischer Bereich, therapeutische Breite und Wirkungsdauer
Der therapeutische Bereich umfasst Dosen oder Konzentrationen, bei denen ein Wirkstoff wirksam ist, ohne dass unerwünschte Wirkungen inakzeptabel werden. Eine breite therapeutische Breite erlaubt mehr Spielraum bei der Dosierung, eine enge therapeutische Breite erfordert eine präzise Anpassung und manchmal Therapeutisches Drug Monitoring.
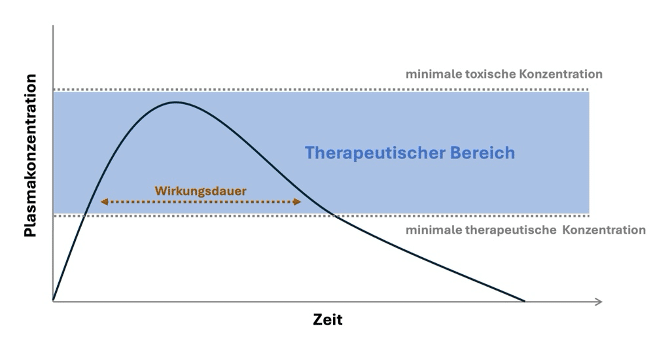
Neben der Stärke der Wirkung spielt auch deren Dauer eine wichtige Rolle für die klinische Anwendung. Die Wirkungsdauer beschreibt, wie lange ein Wirkstoff einen therapeutisch relevanten Effekt entfaltet. Sie hängt oft stark von der Pharmakokinetik ab, kann aber auch pharmakodynamisch geprägt sein, etwa durch die Stabilität der Bindung an die Zielstruktur. Zwei Wirkstoffe können eine vergleichbare maximale Wirkung zeigen, sich jedoch deutlich darin unterscheiden, wie lange dieser Effekt anhält. Die Wirkungsdauer ergänzt damit die Betrachtung der Dosis-Wirkungs-Beziehung um eine zeitliche Dimension, ohne Teil der klassischen Dosis-Wirkungs-Kurve zu sein.
Nebenwirkungen aus pharmakodynamischer Sicht
Nebenwirkungen können auch bei therapeutischen Konzentrationen auftreten. Eine häufige Ursache ist die Verteilung der Zielstrukturen im Körper. Viele Rezeptoren kommen in mehreren Organen vor und erfüllen dort unterschiedliche Funktionen. Wird ein Wirkstoff an mehreren Orten aktiv, entstehen neben der gewünschten Wirkung unerwünschte Effekte.
Ein anschauliches Beispiel sind H1 Antihistaminika der ersten Generation. Sie blockieren Histaminrezeptoren nicht nur peripher, sondern können auch im zentralen Nervensystem wirken und dadurch Müdigkeit verursachen.
Mit steigender Konzentration können unerwünschte Effekte stärker werden und in toxische Wirkungen übergehen. Auch geringe Selektivität, etwa gegenüber Rezeptorsubtypen, kann dazu führen, dass Signalwege beeinflusst werden, die nicht zum therapeutischen Ziel gehören.
Fazit
Pharmakodynamik beschreibt, wie ein Wirkstoff im Körper wirkt und welche biologischen Prozesse er auslöst. Sie erklärt, wie Arzneimittel Zielstrukturen aktivieren oder blockieren, wie sich die Stärke einer Wirkung mit Dosis beziehungsweise Konzentration verändert und warum Patienten unterschiedlich auf dieselbe Substanz reagieren. Damit liefert sie zentrale Grundlagen für Wirksamkeit, Verträglichkeit und sichere Dosierung in der klinischen Praxis.
Weiterführende Literatur:
MSD Manual Professional Version. (o. J.). Pharmacodynamics. https://www.msdmanuals.com/professional/clinical-pharmacology/pharmacodynamics