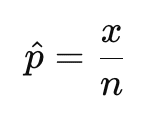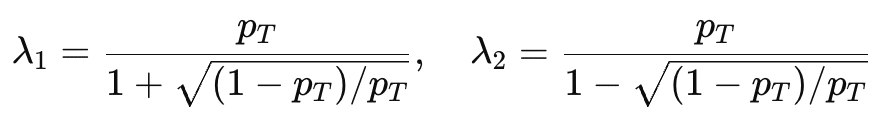In der frühen klinischen Entwicklung neuer Medikamente steht eine zentrale Frage im Vordergrund: Welche Dosis ist sicher und zugleich wirksam genug, um in weiteren Studienphasen getestet zu werden? Phase-I-Studien verfolgen genau dieses Ziel, denn in dieser Phase verabreichen Forschende Patientinnen und Patienten erstmals ein neues Medikament, meist in kleinen Gruppen.
Das Hauptziel besteht darin, die sogenannte Maximum Tolerated Dose (MTD) zu bestimmen, also jene Dosis, bei der Nebenwirkungen noch akzeptabel bleiben. Diese Dosis bildet die Grundlage für spätere Wirksamkeitsstudien und spielt daher eine zentrale Rolle in der Arzneimittelentwicklung.
Traditionell nutzen Forschende dafür einfache regelbasierte Verfahren wie das 3+3 Design. Diese Methoden gelten zwar als robust, stoßen jedoch zunehmend an ihre Grenzen, da sie die vorhandenen Daten nur begrenzt ausschöpfen und dadurch häufig zu ineffizienten oder unpräzisen Dosisentscheidungen führen. Im Gegensatz zu modellbasierten Ansätzen wie der Continual Reassessment Method (CRM) basiert das BOIN Design auf vordefinierten Entscheidungsintervallen und kommt ohne komplexe statistische Modelle aus.
Heute steht mit dem BOIN Design ein moderner Ansatz zur Verfügung, der statistische Effizienz und praktische Umsetzbarkeit vereint. Er ermöglicht eine datengestützte und zugleich transparente Entscheidungsfindung bei der Dosis-Eskalation und Deeskalation und gewinnt in der medizinischen Forschung immer mehr an Bedeutung.
Was ist das BOIN Design
Das BOIN Design, kurz für Bayesian Optimal Interval Design, ist ein statistisches Verfahren zur Dosisfindung in frühen Phasen klinischer Studien. Es wurde von den Biostatistikern Suyu Liu und Yuan Ji entwickelt und 2015 erstmals im Journal of the Royal Statistical Society veröffentlicht. Das Design verfolgt das Ziel, Entscheidungen über die Erhöhung, Senkung oder Beibehaltung einer Dosis auf Grundlage klar definierter Wahrscheinlichkeitsintervalle zu treffen.
Im Gegensatz zu traditionellen Regelverfahren wie dem 3+3 Design nutzt das BOIN Design die beobachteten Daten systematisch. Nach jeder Behandlungsrunde, in der Forschende kleine Gruppen von Patientinnen und Patienten, sogenannte Kohorten, nacheinander behandeln, berechnen sie die Rate dosislimitierender Toxizitäten (dose limiting toxicity, DLT) und vergleichen sie mit einer festgelegten Zieltoxizitätsrate. Als DLT gelten Nebenwirkungen, die eine Fortsetzung der Behandlung nicht zulassen, etwa starke Übelkeit, deutliche Veränderungen des Blutbildes oder schwere Organschäden. Wenn eine Abweichung von der Zielrate vorliegt, passen die Forschenden die Dosis für den weiteren Verlauf entsprechend an.
Diese Entscheidungslogik basiert auf einem Bayesschen Ansatz, kommt jedoch ohne komplexe Simulationen oder Modellanpassungen aus. Dadurch ist das Verfahren sowohl statistisch fundiert als auch in der Praxis leicht anwendbar.
Ursprünglich entwickelten Liu und Ji das BOIN Design für klassische Phase-I-Studien, bei denen die Verträglichkeit neuer Wirkstoffe im Mittelpunkt steht. Inzwischen gibt es jedoch mehrere Erweiterungen, die den Einsatz über die reine Sicherheitsprüfung hinaus ermöglichen. Dazu gehören Varianten, die Wirksamkeitsdaten berücksichtigen (BOIN12), zeitabhängige Toxizitäten einbeziehen (TITE BOIN) oder unterschiedliche Schweregrade unerwünschter Ereignisse abbilden (BOIN ET). Diese Weiterentwicklungen machen das BOIN Design zu einem flexiblen Instrument, das auch in Phase-I/II-Studien sowie in modernen Therapieformen wie Immuntherapien oder Zelltherapien eingesetzt werden kann.
Statistische Grundlage und Entscheidungslogik
Das BOIN Design beruht auf einer festgelegten Entscheidungsregel, die sich auf Prinzipien der Bayesschen Statistik stützt. Ziel ist es, nach jeder Behandlungsrunde auf objektiver Basis zu bestimmen, ob die Dosis erhöht, verringert oder unverändert beibehalten werden soll. Grundlage dieser Entscheidung sind die in der jeweiligen Kohorte beobachteten DLTs.
Im Mittelpunkt steht die sogenannte Zieltoxizitätsrate, die in der Regel zwischen 20 und 30 Prozent liegt. Sie beschreibt den Anteil der Behandelten, bei denen Toxizitäten in einem noch akzeptablen Umfang auftreten.
Forschende berechnen die beobachtete Toxizitätsrate einer Kohorte als:
wobei x die Anzahl der Behandelten mit einer DLT bezeichnet und n die Anzahl der Behandelten in dieser Kohorte ist.
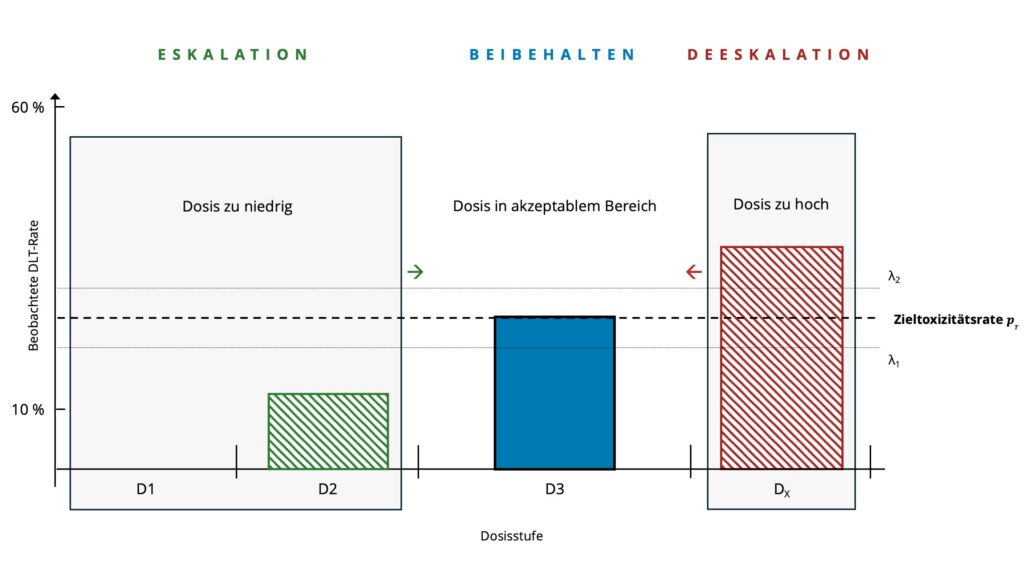
Anschließend vergleichen die Forschenden die beobachtete Rate mit zwei Entscheidungsgrenzen. Diese Grenzen legen fest, in welchem Bereich eine Dosis als akzeptabel gilt. Liegt die beobachtete Rate unterhalb der unteren Grenze λ₁, ist die Dosis wahrscheinlich zu niedrig, und eine Eskalation ist angezeigt. Liegt sie oberhalb der oberen Grenze λ₂, gilt die Dosis als zu toxisch und sollte verringert werden. Befindet sich die beobachtete Rate zwischen diesen beiden Grenzen, bleibt die aktuelle Dosis unverändert.
Die Werte λ₁ und λ₂ bestimmen die Forschenden mithilfe eines Bayesschen Optimierungsansatzes. Dieses Verfahren minimiert das Risiko, eine falsche Entscheidung zu treffen, etwa eine Dosis zu erhöhen, obwohl sie bereits zu toxisch ist. Liu und Yuan (2015) leiteten dafür analytische Formeln ab, die sich aus der Zieltoxizitätsrate pT, zum Beispiel 0,25, berechnen lassen:
Nach jeder behandelten Kohorte bewerten die Forschenden die beobachteten Daten mithilfe einer Bayes’schen Aktualisierung. Als Ausgangspunkt dient eine uninformierte Beta-Verteilung, die die Unsicherheit über die wahre Toxizitätsrate beschreibt. Diese Verteilung zeigt, wie wahrscheinlich verschiedene Werte der Toxizitätsrate sind, basierend auf den bisherigen Beobachtungen. Anschließend berechnen die Forschenden, wie wahrscheinlich es ist, dass die wahre Toxizitätsrate unterhalb der unteren Grenze λ₁, innerhalb des Intervalls [λ₁, λ₂] oder oberhalb der oberen Grenze λ₂ liegt. Die Dosisentscheidung erfolgt dann nach dem Prinzip des Bayes’schen Risiko-Minimums. Das bedeutet, dass diejenige Option gewählt wird, die im Mittel die geringste Wahrscheinlichkeit einer Fehlklassifikation hat.
Beispiel aus der medizinischen Praxis
Ein Beispiel aus der onkologischen Forschung verdeutlicht das Prinzip des BOIN Designs. Angenommen, Forschende testen in einer Phase-I-Studie ein neues Krebsmedikament. Ziel ist es, die Dosis zu bestimmen, bei der schwerwiegende Nebenwirkungen bei etwa einem Viertel der Behandelten auftreten (Zieltoxizitätsrate 25 %).
An der Studie nehmen 32 Patientinnen und Patienten teil, die in Kohorten zu jeweils acht Personen die gleiche Dosis erhalten. Welche Dosisstufe eine Kohorte bekommt, hängt von den Ergebnissen der vorherigen Gruppe ab. Nach jeder Kohorte entscheiden die Forschenden auf Grundlage der beobachteten Nebenwirkungen, ob die nächste Gruppe eine höhere, gleiche oder niedrigere Dosis erhält.

Die Studie beginnt mit der niedrigsten von fünf Dosisstufen. In der ersten Kohorte zeigen sich keine DLTs. Die beobachtete Toxizitätsrate liegt somit bei 0 Prozent und damit deutlich unterhalb des Zielintervalls. Das BOIN Design sieht in diesem Fall eine Eskalation auf die nächsthöhere Dosisstufe vor. In der zweiten Kohorte zeigt sich bei einer von acht Personen eine DLT (12,5 %), weshalb die Dosis erneut erhöht wird.
In der dritten Kohorte behandeln die Forschenden acht Personen mit der nächsthöheren Dosis. Dabei treten zwei DLTs auf (25 %). Diese Rate liegt im akzeptablen Bereich zwischen den Entscheidungsgrenzen, weshalb die Dosis beibehalten wird. In der Praxis bedeutet das, dass eine weitere Kohorte dieselbe Dosis erhält, um zu prüfen, ob die Toxizitätsrate stabil bleibt. Wenn sich dieses Ergebnis über mehrere Kohorten bestätigt oder die maximal vorgesehene Zahl an Teilnehmenden erreicht ist, gilt diese Dosis als MTD. Danach kann die nächste Studienphase beginnen, in der Forschende die Wirksamkeit dieser Dosis in einer größeren Patientengruppe untersuchen.
Wäre in einer Kohorte eine höhere DLT-Rate aufgetreten (z. B. 37,5 %), hätte die beobachtete Toxizitätsrate oberhalb des oberen Grenzwerts gelegen. In diesem Fall wäre eine Verringerung auf die nächstniedrigere Dosisstufe vorgesehen, um die Sicherheit der Patientinnen und Patienten zu gewährleisten.
Umsetzung und Software
Für die praktische Umsetzung des BOIN Designs stehen heute mehrere spezialisierte Softwarelösungen zur Verfügung. Besonders verbreitet ist das gleichnamige R-Paket BOIN, das die Entwickler Liu und Yuan bereitgestellt haben. Mit diesem Paket können Forschende Dosis-Eskalationsstrategien festlegen, Entscheidungsgrenzen berechnen und Simulationen durchführen, um die Leistungsfähigkeit des Designs zu bewerten.
Bevor ein Studienprotokoll abgeschlossen wird, führen Forschende in der Regel zahlreiche Simulationen durch, um das Verhalten des Designs unter verschiedenen Annahmen zu überprüfen. Dabei simulieren sie Szenarien mit unterschiedlichen Toxizitätsraten, um sicherzustellen, dass das Design zuverlässig zur geeigneten Dosis führt und gleichzeitig die Sicherheit der Patientinnen und Patienten gewährleistet bleibt.
Für Forschungseinrichtungen und Unternehmen, die klinische Studien planen, bietet das BOIN Design eine flexible und wissenschaftlich fundierte Grundlage. Die Anwendung setzt jedoch Erfahrung im Umgang mit Simulationsverfahren und in der Interpretation der Ergebnisse voraus.
Fazit
Das BOIN Design zählt heute zu den modernsten Verfahren der Dosisfindung in klinischen Studien. Es verbindet die einfache Handhabung klassischer Regelverfahren mit der statistischen Präzision der Bayesschen Entscheidungslogik und ermöglicht dadurch fundierte und nachvollziehbare Entscheidungen während der Studienphase.
Seine größten Stärken liegen in der hohen Patientensicherheit, der Transparenz und der Effizienz bei der Bestimmung optimaler Dosierungen. Die Entscheidungen beruhen auf klar definierten Wahrscheinlichkeitsintervallen und sind dadurch sowohl für Forschende als auch für Ethikkommissionen gut nachvollziehbar. Das verringert unnötige Dosissteigerungen und trägt dazu bei, dass mehr Patientinnen und Patienten auf einer angemessenen Dosis behandelt werden.
Während das BOIN Design Entscheidungsintervalle nutzt, um die optimale Dosis zu bestimmen, arbeitet die CRM mit einem statistischen Modell, das die Dosis-Wirkungs-Beziehung fortlaufend anpasst.
Wie jedes statistische Verfahren erfordert auch das BOIN Design eine sorgfältige Planung. Die Zieltoxizitätsrate muss vorab sorgfältig definiert werden, und in kleinen Studien können Zufallseinflüsse die Interpretation erschweren. In größeren Studien überzeugt das Verfahren jedoch durch seine ausgewogene Verbindung von Transparenz, Datenorientierung und methodischer Strenge. Diese Eigenschaften tragen wesentlich dazu bei, die Sicherheit und Aussagekraft klinischer Forschung zu erhöhen.
Weiterführende Literatur:
Liu, S., & Yuan, Y. (2015). Bayesian optimal interval designs for phase I clinical trials. Journal of the Royal Statistical Society: Series C (Applied Statistics), 64(3), 507–523. https://doi.org/10.1111/rssc.12089
Yan, F., Zhang, L., Zhou, Y., Pan, H., Liu, S., & Yuan, Y. (2020). BOIN: An R package for designing single-agent and drug-combination dose-finding trials using Bayesian optimal interval designs. Journal of Statistical Software, 94(13), 1–32. https://doi.org/10.18637/jss.v094.i13
Liu, S., & Yuan, Y. (2023). BOIN: Bayesian optimal interval designs for single-agent and drug-combination phase I trials (Version 3.6) [R package]. Comprehensive R Archive Network (CRAN). https://cran.r-project.org/package=BOIN