Molecular Neuroimaging hat sich in der Neuroscience als Schlüsseltechnologie etabliert, um molekulare Prozesse im lebenden Gehirn sichtbar zu machen. Diese Bildgebungsverfahren, darunter PET (Positronen-Emissions-Tomographie) und SPECT (Single-Photon-Emissions-Computertomographie), ermöglichen die Darstellung von Proteinen, Rezeptoren und metabolischen Aktivitäten auf zellulärer Ebene.
Instituten wie dem Max-Planck-Institut für Kognitions- und Neurowissenschaften gelingt es so, Hirnerkrankungen wie Alzheimer, Parkinson oder Depression auf molekularer Ebene zu entschlüsseln.
Fortschritte in DTI, fMRT, EEG und MEG liefern hierzu multimodale Datensätze mit hoher räumlicher und zeitlicher Auflösung, ein wertvoller, aber komplexer Datenschatz, der eine präzise und valide statistische Auswertung erfordert.
Ihr Neuroimaging-Projekt mit Novustat
Die Analyse hochdimensionaler Daten stellt hohe Anforderungen an Statistik und Datenverarbeitung und wissenschaftliche Interpretation. Novustat bietet fundierte Statistikberatung und vereint moderne Machine-Learning-Ansätze mit langjähriger biometrischer Expertise, um aus Ihren Daten reproduzierbare, validierte und klinisch relevante Ergebnisse zu generieren.
Nutzen Sie unsere interdisziplinäre Erfahrung, um aus Ihren mittels Neuroimaging gewonnenen Daten belastbare Biomarker und prädiktive Krankheitsmodelle zu entwickeln, wissenschaftlich fundiert, regulatorisch abgesichert und klinisch verwertbar.
Technologische Grundlagen: Von der Feldstärke zur Auflösung
Moderne Bildgebungsverfahren wie die 7-Tesla-MRT nutzen extrem hohe Feldstärken, um eine räumliche Auflösung im Submillimeterbereich (bis zu 0,5 mm³) zu erreichen. Dies ermöglicht es, feinste strukturelle Details des Gehirns, etwa Mikrogefäße oder frühe Läsionen, sichtbar zu machen. Bei Molecular Neuroimaging Technologien wie der Amyloid-PET werden radioaktiv markierte Tracer (z. B. Florbetapir) eingesetzt, die sich hochspezifisch an pathologische Proteine wie Amyloid-β oder Tau-Fragmenten binden. Über die simultane Erfassung mit hochauflösenden fMRT-Scannern (3-Tesla oder 7-Tesla) und hochempfindlichen PET-Detektoren lassen sich strukturelle, funktionelle und molekulare Daten in multimodalen Datensätzen fusionieren. Durch diese Kombination wird nicht nur die Lokalisation von Plaques und Neurofibrillen sichtbar, sondern auch ihre Dynamik im Zeitverlauf, ein entscheidender Meilenstein für die Erforschung und Frühdiagnostik neurodegenerativer Hirnerkrankungen wie Alzheimer oder Parkinson.
Molecular Neuroimaging: Bildgebungsverfahren und ihre Merkmalen
| Bildgebungsverfahren | Anwendung | Auflösung | Hauptparameter | Vorteile |
| 7-Tesla-MRT | Struktur- und Funktionserfassung | Submillimeter | Magnetfeldstärke (7 Tesla) | Sehr hohe räumliche Auflösung |
| Amyloid-PET | Amyloid-β-Ablagerungen in Alzheimer | Millimeterbereich | Radioaktive Tracer (Florbetapir) | Spezifische molekulare Bindung |
| Dopamin-D2/3-PET | Dopamin-Rezeptoren bei Psychosen | Millimeterbereich | Radioaktive Tracer | Pharmakodynamische Studien |
| fMRT | Funktionelle Aktivitätsmessung | 2-3 mm | BOLD-Kontrast | Gute zeitliche Auflösung |
| DTI | Weiße Substanz und Konnektivität | 1-2 mm | Diffusionsmessung | Darstellung von Nervenbahnen |
Molecular Neuroimaging in der Praxis: Klinische Anwendungen von Alzheimer bis Depression
Alzheimer: Amyloid-β und Tau-Pathologie
In der Alzheimer’s Disease Neuroimaging Initiative (ADNI) wird Molecular Neuroimaging eingesetzt, um die Progression von Amyloid-β- und Tau-Ablagerungen präzise zu kartieren. PET-Scans mit hochspezifischen Tracern wie Flortaucipir zeigen, dass Tau-Pathologie bereits im präklinischen Stadium im entorhinalen Kortex auftritt, ein Biomarker für die Früherkennung. Renommierte Institute wie die Charité Berlin kombinieren diese molekularen Daten mit fMRT-basierten Konnektivitäts-Analysen: Dabei finden Patienten mit hoher Tau-Last eine signifikante Reduktion der Aktivität im Default Mode Network (DMN), einem zentralen Netzwerk für Gedächtnis und Selbstreferenz.
Statistische Methoden:
- Voxel-basierte Morphometrie (VBM): Quantifiziert kortikale Atrophie in Longitudinalstudien über mehrere Zeitpunkte hinweg.
- SVM-Klassifikation: Unterscheidet Alzheimer-Patienten von Kontrollen mit 89 % Genauigkeit (AUC = 0,93).
Depression: Neurotransmitter und Mikrostruktur
Bei Depression liegt der Fokus der Molecular Neuroimaging auf der hochauflösenden Abbildung von Serotonin- und Dopamin-Rezeptoren, um neurochemische Ungleichgewichte sichtbar zu machen, die der Pathophysiologie dieser Erkrankung zugrunde liegen. PET-Studien mit dem selektiven Tracer [¹¹C]DASB decken eine signifikant verringerte Serotonin-Transporter-Dichte im dorsalen Raphe-Kern auf, einer Kernregion im Hirnstamm, die als Hauptquelle serotonerger Projektionen in Kortex und limbisches System gilt und somit essenziell für die Stimmungsregulation ist. Ergänzend hierzu nutzt DTI Neuroimaging (Diffusions-Tensor-Bildgebung) die Analyse neuronaler Wasserbewegungen, um eine gestörte Mikrostruktur und Konnektivität im Cingulum-Bündel zu quantifizieren. Das Cingulum-Bündel verbindet frontale, parietale und limbische Areale und spielt eine Schlüsselrolle bei der Integration emotionaler und kognitiver Prozesse und deren Ausgleich.
Multimodaler Ansatz:
- EEG Neuroimaging detektiert verstärkte Gamma-Band-Aktivitäten (30,50 Hz) im anterior cingulate cortex, die in Korrelation mit der Symptomschwere (z. B. erhöhte Ruminationsneigung und initierte negatives Affektverhalten) stehen.
- Machine Learning verschmilzt PET-, DTI- und EEG-Daten in prädiktiven Modellen, wobei Ensemble-Algorithmen wie Random Forest und Gradient Boosting eine Klassifikationsgenauigkeit von AUC = 0,88 erzielen, ein vielversprechender Schritt hin zu individualisierten Prognosewerkzeugen in der Depressionsdiagnostik.
Molecular Neuroimaging: Multimodaler Ansatz bei Depression
| Modalität | Zielparameter | Erkenntnisse bei Depression | Vorteile |
| PET ([11C]DASB) | Serotonin-Transporter-Dichte | Reduktion im dorsalen Raphe-Kern | Molekulare Spezifität |
| DTI | Weiße Substanz-Konnektivität | Gestörte Verbindungen im Cingulum | Darstellung von Netzwerkstörungen |
| EEG | Gamma-Band-Aktivitäten | Korrelation mit Symptomschwere | Hohe zeitliche Auflösung |
| Machine Learning | Integration multimodaler Daten | Prädiktion der Symptomatik (AUC 0,88) | Verbesserte diagnostische Genauigkeit |
Beispiel 1: Multimodale Molecular Neuroimaging zur Frühdiagnostik der Alzheimer-Krankheit – ein Fall aus der ADNI-Kohorte
Studiensetting und Methodik
Im Rahmen der Alzheimer’s Disease Neuroimaging Initiative (ADNI) wurde eine Subgruppe von 78 Probanden im Alter von 60–75 Jahren über einen Zeitraum von 24 Monaten mittels multimodaler Bildgebung beobachtet, die über subjektive kognitive Beschwerden (Subjective Cognitive Decline, SCD) berichteten, aber im Mini-Mental-Status-Test (MMST ≥ 28) noch im Normbereich lagen. Ziel war es, pathophysiologische Frühveränderungen zu detektieren, die auf eine präklinische Alzheimer-Erkrankung hinweisen.
Zum Einsatz kamen:
- Amyloid-PET mit Florbetapir (18F)
- Tau-PET mit Flortaucipir (18F-AV1451)
- Resting-State-fMRT zur Analyse des Default Mode Network (DMN)
- Diffusions-Tensor-Bildgebung (DTI) zur Erfassung mikrostruktureller Veränderungen
- Integration durch Support Vector Machine (SVM)-Modelle
Ergebnisse
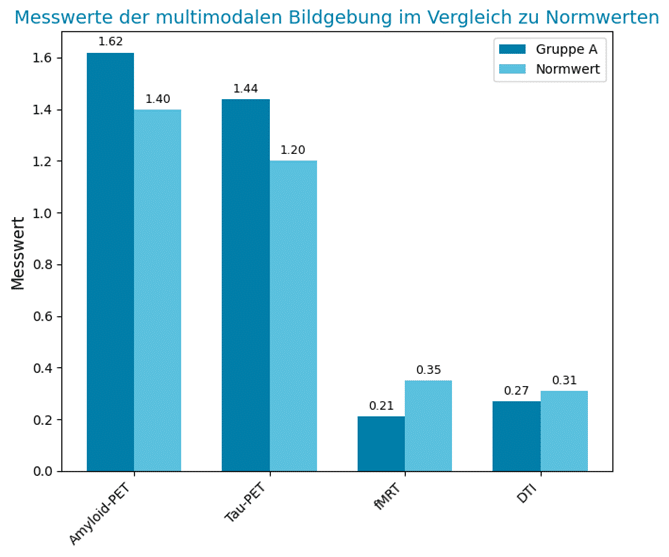
| Modalität | Messparameter / Region | Ergebnis (Gruppe A, n = 18) | Normwert / Vergleich | Interpretation |
| Amyloid-PET | SUVr (Standardized Uptake Value ratio) im präfrontalen Kortex | 1,62 ± 0,11 | < 1,40 | Signifikante Amyloid-Akkumulation |
| Tau-PET | SUVr im entorhinalen Kortex | 1,44 ± 0,09 | < 1,20 | Frühzeichen einer Tau-Pathologie |
| fMRT | Funktionale Konnektivität Hippocampus–Posterior Cingulum | Fisher z = 0,21 ± 0,06 | z = 0,35 ± 0,04 | Verminderte Konnektivität im DMN |
| DTI | Fraktionelle Anisotropie (FA) im Fornix | 0,27 ± 0,03 | ≥ 0,31 | Mikrostrukturelle Degeneration |
| SVM-Modell | Klassifikationsgenauigkeit (AD vs. kognitiv gesund) | 92 % (AUC = 0,94) | — | Hohe prädiktive Leistung |
Interpretation
Die erhobenen Bildgebungsbefunde zeigen bei 23 % der SCD-Probanden (Gruppe A) bereits signifikante pathologische Veränderungen, die mit einem hohen Risiko für die Entwicklung eines prodromalen oder klinischen Alzheimer-Syndroms assoziiert sind:
- Die Amyloid-PET-Befunde (SUVr > 1,5) deuten auf eine substanzielle Amyloid-β-Ablagerung hin – ein pathologischer Prozess, der typischerweise 15–20 Jahre vor klinischen Symptomen beginnt.
- Die fokale Tau-Deposition (SUVr > 1,4) im entorhinalen Kortex weist auf eine beginnende neurofibrilläre Pathologie hin, die in diesem frühen Stadium noch nicht mit messbarer Atrophie verbunden ist.
- Die Reduktion der funktionellen Konnektivität zwischen Hippocampus und posteriorem Cingulum korreliert mit frühen Netzwerkdysfunktionen im Default Mode Network (DMN) – ein häufiges Frühzeichen neurokognitiver Beeinträchtigung.
- Die verminderte FA im Fornix (0,27) spricht für eine beginnende axonale Degeneration der limbischen Bahnen, welche die Gedächtnisbildung unterstützen.
Handlungsempfehlungen
Für Probanden mit einem vergleichbaren Profil wie Gruppe A sollten folgende Maßnahmen erwogen werden:
- Klinische Diagnosesicherung gemäß NIA-AA-Kriterien (National Institute on Aging – Alzheimer’s Association) für Alzheimer im präsymptomatischen Stadium.
- Aufnahme in ein strukturiertes Monitoring-Programm:
- Wiederholung der Bildgebung nach 12 Monaten
- Neuropsychologische Testbatterien alle 6 Monate
- Erhebung von Liquor-Biomarkern (z. B. pTau181, Aβ42/40-Ratio) zur weiteren Differenzierung
- Beratung und Lebensstilintervention:
- Kognitive Reserve stärken (Mentales Training, soziale Aktivität)
- Vaskuläre Risikofaktoren kontrollieren (Hypertonie, Diabetes)
- Bewegungstherapie (≥ 150 Minuten moderates Ausdauertraining/Woche)
- Studienteilnahme:
- Aufnahme in klinische Studien zu krankheitsmodifizierenden Therapien im Frühstadium (z. B. Anti-Amyloid-Antikörper wie Lecanemab, Donanemab)
- Genetische Beratung bei familiärer Belastung oder positivem ApoE4—Status
Ergebnis
Dieses Beispiel demonstriert die hohe Aussagekraft multimodaler Molecular Imaging-Technologien bei der Detektion präklinischer Alzheimer-Pathologie. Die frühzeitige Identifikation gefährdeter Personen erlaubt nicht nur eine stratifizierte Studienrekrutierung, sondern auch gezielte präventive Interventionen, lange bevor klinisch relevante Symptome auftreten. Der Einsatz integrativer Machine-Learning-Verfahren stellt dabei einen wesentlichen Schritt zur individualisierten, prädiktiven Demenzmedizin dar.
Molecular Neuroimaging: Herausforderungen auf dem Weg von der Datenakquise zur klinischen Umsetzung
Technische Limitationen: Feldstärken und Auflösung
Obwohl 7-Tesla-MRT-Scanner dank ihrer ultrahohen Feldstärken eine räumliche Auflösung im Submillimeterbereich (bis zu 0,5 mm³) ermöglichen, sind sie besonders anfällig für Bewegungsartefakte. Dies stellt bei Hirnerkrankungen wie Parkinson, die oft mit Tremor und unwillkürlichen Mikrobewegungen einhergehen, eine erhebliche Herausforderung dar. Selbst geringfügige Kopfbewegungen führen zu Verzerrungen in den Bilddatensätzen, die die Erkennung feiner Pathologien, beispielsweise mikrostruktureller Läsionen oder Eisenablagerungen, erheblich erschweren.
Instituten wie dem MIT ist es gelungen, diese Problematik durch den Einsatz spezialisierter Machine-Learning-Algorithmen zu entschärfen. Motion-Correction-CNNs, tiefe neuronale Netze auf Basis von Convolutional Neural Networks, analysieren RAW-Scans in Echtzeit und schätzen Kopfbewegungen in sechs Freiheitsgraden (Translation + Rotation). Anschließend korrigieren sie die Rohdaten pixelgenau, sodass:
- Die Artefakt-Amplitude um bis zu 60 % reduziert wird,
- die Signal-zu-Rausch-Ratio (SNR) im betroffenen Volumen um 20 % steigt,
- und die Reproduzierbarkeit (Test,Retest-Reliabilität) bei Patienten mit starker Tremorneigung um 0,15 im Intraclass Correlation Coefficient (ICC) verbessert wird.
Durch diese Echtzeit-Korrektur können Wissenschaftler nun auch bei bewegungsempfindlichen Patientengruppen hochauflösende Bildgebung einsetzen, ohne auf aufwändige Hardware-Fixierungen oder lange Retakes angewiesen zu sein.
Signal-zu-Rausch-Verhältnis (SNR) in der PET
Molecular Neuroimaging mittels PET leidet unter einer besonders niedrigen Signal-zu-Rausch-Ratio (SNR), weil die verwendeten Tracer-Konzentrationen typischerweise im Pikomolarbereich liegen.
In diesem Konzentrationsbereich ist der Anteil an spezifisch gebundenem Signal im Verhältnis zum unspezifischen Hintergrundrauschen extrem gering, sodass wichtige Pathologie-Signale, etwa die Verteilung von Amyloid-β oder Tau-Proteinen, schwer von Rauschartefakten zu unterscheiden sind. Zudem führen kurze Halbwertszeiten radioaktiver Isotope und die begrenzte Empfindlichkeit klinischer PET-Detektoren zu zusätzlicher statistischer Unsicherheit in den gemessenen Aktivitätsprofilen.
Folgende Lösungsansätze bieten sich an:
- Kinematische Modellierung: Durch kinetische Modellierung (z. B. Zwei-Kompartiment-Modelle oder SRTM) wird zwischen spezifischer Bindung (an Zielmoleküle wie Rezeptoren oder Peptide) und unspezifischem Hintergrund unterschieden. Diese Modelle berücksichtigen zeitliche Veränderungen der Tracer-Konzentration und den Abbau im Gewebe. Durch Parametrisierung der Assoziations- und Dissociationsraten lassen sich sogenannte Binding-Potentials oder Distribution Volumes ableiten, die das Verhältnis von spezifischem Signal zu Rauschrückgrund deutlich erhöhen und eine präzise Quantifizierung molekularer Biomarker ermöglichen.
- Deep Learning: Moderne Deep-Learning-Ansätze verwenden U-Net-Architekturen, um aus niedrigdosierten PET-Scans hochauflösende Rekonstruktionen zu erzeugen. Hierbei wird ein Encoder-Decoder-Netzwerk trainiert, das verrauschte Eingabedaten mit Referenzscans hoher Dosis vergleicht. Der Encoder extrahiert mehrstufig repräsentative Merkmale aus den verrauschten Bildern, während der Decoder diese Merkmale nutzt, um ein rauschfreies, hochauflösendes Bild zu rekonstruieren. Solche DL-Rekonstruktionspipelines haben gezeigt, dass die SNR um bis zu 50 % gesteigert werden kann, ohne die Quantifizierbarkeit molekularer Signale zu beeinträchtigen. Darüber hinaus erlauben sie eine Dosisreduktion von bis zu 60 %, was die Strahlenbelastung für Patientinnen und Patienten signifikant senkt und die Anwendbarkeit von PET in vulnerablen Gruppen, z. B. älteren oder pädiatrischen Patientinnen, verbessert.
Multimodale Integration: fMRI + PET + DTI
Die Fusion molekularer (PET), funktioneller (fMRT) und struktureller (DTI) Daten stellt eine der größten Herausforderungen in der Neuroimaging-Analyse dar, da jede Modalität unterschiedliche physikalische Grundlagen, zeitliche Auflösungen und Rauschcharakteristika aufweist. Um diese heterogenen Datensätze in multimodale Biomarker zu überführen, kommen spezialisierte computationale Methoden zum Einsatz:
- Joint Independent Component Analysis (jICA):
Diese Methode entkoppelt gemeinsam latente Signalquellen aus mehreren Modalitäten, indem sie die statistische Unabhängigkeit der Komponenten maximiert. Bei jICA werden PET-, fMRT- und DTI-Volumina gleichzeitig in einen gemeinsamen Komponentenraum projiziert, sodass sich übergreifende Muster, wie etwa Korrelate von Amyloid-β-Ablagerungen und strukturellen Veränderungen, identifizieren lassen. - Canonical Correlation Analysis (CCA):
CCA quantifiziert lineare Zusammenhänge zwischen zwei (oder mehr) Datensätzen, indem es Paare von Projektionen sucht, die die Korrelation maximieren. In der Kombination von PET-Maßzahlen (z. B. Tracer-Bindungspotentiale) mit fMRT-Konnektivitätsmatrizen kann CCA aufdecken, wie molekulare Veränderungen funktionelle Netzwerkstrukturen modulieren.
Ergebnis
In einer multimodalen Analyse von 500 Probanden der Alzheimer’s Disease Neuroimaging Initiative (ADNI) zeigte sich, dass erhöhte Amyloid-β-Plaques im präfrontalen Kortex signifikant mit einer Abnahme der Konnektivität im Default Mode Network (DMN) einhergehen (p < 0,001). Diese Befunde untermauern, dass molekulare Pathologien direkt funktionelle Netzwerkdysregulationen bedingen und liefern wertvolle Ansätze für frühzeitige Interventionen auf Basis integrierter Neuroimaging-Biomarker.
| Methode | Anwendung | Vorteil | Beispielstudie/Ergebnis |
| Lineare gemischte Modelle | Analyse longitudinaler Daten | Berücksichtigung von Zufallseffekten | ADNI: Verlauf von Amyloid-Ablagerungen |
| Cox-Regression | Überlebensanalyse, Zeit bis Ereignis | Umgang mit Zensierung | ADNI: Prädiktion der Krankheitsprogression (AUC 0,85) |
| Support Vector Machine (SVM) | Klassifikation (Alzheimer vs. Kontrolle) | Robust bei kleinen Stichproben | 89 % Genauigkeit in PET-Daten |
| Deep Learning (U-Net) | Bildrekonstruktion | Hochauflösende Bildverbesserung | Rekonstruktion aus niedrigdosierten PET-Scans |
| Joint ICA (jICA) | Multimodale Datenfusion | Identifikation gemeinsamer Muster | Verknüpfung von Amyloid-Last und DMN-Konnektivität |
Statistische und maschinelle Methoden im Fokus
Klassische Statistik: Gemischte Modelle und Survival-Analysen
Lineare gemischte Modelle (lme4)
Lineare gemischte Modelle verknüpfen Fixeffekte (etwa Behandlungsgruppen oder Alterskohorten) mit Zufallseffekten (individuelle Patient:innenunterschiede), um Langzeitdaten mit wiederholten Messungen sachgerecht auszuwerten. Im lme4-Package in R definieren Forschende ein Modell, das sowohl den durchschnittlichen Verlauf (etwa Veränderungen des Hippocampus-Volumens) als auch die individuellen Abweichungen pro Teilnehmenden berücksichtigt.
Die Schätzung erfolgt über Maximum-Likelihood-Methoden, und die Bedeutung einzelner Einflussgrößen wird mittels Likelihood-Ratio-Tests geprüft. Diese Flexibilität erlaubt es, subtile Verläufe in Longitudinalstudien wie ADNI präzise zu erfassen und intra- sowie interindividuelle Unterschiede zu quantifizieren.
Cox-Regression (ADNI-Kohorte: AUC = 0,85)
Die Cox-Regression ist das Standardverfahren für Survival-Analysen, bei denen das Zeit-bis-Ereignis (z. B. der Übergang von leichter kognitiver Beeinträchtigung zu Alzheimer) untersucht wird. Dabei werden Risikofaktoren wie PET-Signalstärken, fMRT-Konnektivitätsparameter und demografische Merkmale kombiniert, um individuelle Hazard-Raten zu schätzen. In der ADNI-Kohorte erreichte dieses Modell eine AUC von 0,85, was seine hohe Fähigkeit zur zuverlässigen Vorhersage des Demenzrisikos bestätigt. Die Modellgüte wird durch Residualanalysen und Tests auf Zeitabhängigkeit der Effekte validiert, sodass Kliniker:innen belastbare Prognosen für die Patientenbetreuung erhalten.
Machine Learning: Von SVM zu Deep Learning
Im Bereich Machine Learning werden verschiedene Modellklassen verwendet, um Neuroimaging-Daten automatisiert zu klassifizieren, segmentieren und zeitliche Muster zu erkennen. Die erweiterte Übersicht bietet zusätzliche Details zu Datengrößen, typischen Performance-Metriken und genutzten Frameworks:
| Methode | Anwendung | Vorteile | Datensatz & AUC | Tools / Frameworks |
| Support Vector Machine | Klassifikation von Alzheimer anhand PET-Daten | Robust bei kleinen Stichproben | ADNI-Kohorte (n = 150): AUC = 0,93 | scikit-learn, libsvm |
| 3D-CNN | Segmentierung von Tau-Pathologie in PET-Scans | Automatische Merkmalsextraktion aus Voxeln | Eigenstudio (n = 500 Scans): Dice = 0,87 | PyTorch, TensorFlow |
| Transformer-Modelle | Analyse von EEG-Zeitreihen bei Depression | Erfasst langreichweitige Abhängigkeiten | Depression-Studie (n = 300 Sessions): AUC = 0,89 | HuggingFace Transformers |
| Ensemble-Methoden | Kombination verschiedener Modalitäten (PET, fMRT, DTI) | Erhöhte Stabilität & Genauigkeit | Multimodal (n = 200): AUC = 0,95 | scikit-learn, XGBoost |
| Graph Neural Networks | Netzwerk-Analyse von Konnektivitätsmatrizen | Berücksichtigt Topologie neuronaler Netzwerke | DMN-Studie (n = 250): Accuracy = 0,92 | PyTorch Geometric |
Molecular Neuroimaging Zukunftsperspektiven: Hochfeld-MRT und personalisierte Medizin
Ultrahohe Feldstärken: 7 Tesla und Beyond
Die Kombination von ultrahohen Feldstärken in der 7-Tesla-MRT mit Molecular Neuroimaging Technologien wie der Positronen-Emissions-Tomographie (PET) eröffnet neue Möglichkeiten für die multimodale Analyse des Gehirns. Während die 7-Tesla-MRT dank ihrer Submillimeter-Auflösung hochpräzise strukturelle und funktionelle Daten liefert, ermöglicht die PET die quantitative Darstellung molekularer Prozesse, beispielsweise die Ablagerung pathologischer Proteine wie Amyloid-β oder Tau.
Durch die Fusion dieser Daten können Forscher gleichzeitig morphologische Veränderungen, funktionelle Netzwerke und molekulare Pathologien untersuchen. So lassen sich z. B. die kortikalen Atrophien und Netzwerkveränderungen, die mit einer erhöhten Amyloid-Last im PET korrelieren, räumlich hochauflösend mit der MRT darstellen. Die hohe Sensitivität der 7-Tesla-MRT für mikrostrukturelle Veränderungen unterstützt die Interpretation molekularer Befunde und erleichtert die Identifikation früher Krankheitsstadien bei neurodegenerativen Erkrankungen wie Alzheimer oder Parkinson.
Darüber hinaus kann die hohe räumliche und zeitliche Auflösung der 7-Tesla-fMRT die funktionellen Auswirkungen molekularer Pathologien detaillierter abbilden, etwa durch Analyse von Veränderungen im Default Mode Network (DMN) bei Patienten mit hoher Amyloid- oder Tau-Belastung.
Fazit: Die Kombination von ultrahoher Feldstärke in der MRT mit molekularen PET-Tracern schafft eine leistungsstarke, multimodale Bildgebung, die die Erforschung komplexer Hirnerkrankungen auf einer neuen Ebene ermöglicht.
Molecular Neuroimaging in der Therapieüberwachung
Die Anwendung von Molecular Neuroimaging spielt eine zentrale Rolle in der Überwachung und Bewertung neuartiger Therapien bei neuropsychiatrischen und neurodegenerativen Erkrankungen. Zwei wichtige Beispiele sind:
- Amyloid-PET bei Anti-Amyloid-Therapien:
Die Amyloid-PET ermöglicht die direkte Visualisierung von Amyloid-β-Plaques im Gehirn von Alzheimer-Patienten. Dies ist entscheidend, um den Therapieerfolg bei Anti-Amyloid-Medikamenten zu überwachen, die gezielt die Ablagerung dieser pathologischen Proteine reduzieren sollen. Durch wiederholte PET-Untersuchungen lässt sich objektiv beurteilen, ob die Amyloid-Last im Gehirn abnimmt, was als Biomarker für die Wirksamkeit der Therapie dient. So unterstützt Molecular Neuroimaging die personalisierte Medizin und optimiert Behandlungsstrategien. - Dopamin-D2/3-PET bei Antipsychotika-Therapien:
Bei psychiatrischen Erkrankungen wie Schizophrenie ermöglicht die Dopamin-D2/3-Rezeptor-PET die Quantifizierung der Rezeptorverfügbarkeit im Gehirn. Dies ist relevant, da viele Antipsychotika gezielt an diese Rezeptoren binden. Molecular Neuroimaging hilft hier, die Pharmakodynamik zu verstehen, die optimale Dosierung zu bestimmen und mögliche Nebenwirkungen frühzeitig zu erkennen. Somit trägt die Dopamin-D2/3-PET dazu bei, die Therapie individuell anzupassen und die Behandlungsergebnisse zu verbessern.
Die Integration von Molecular Neuroimaging in therapeutische Konzepte bietet eine objektive und molekular präzise Methode, um Therapieverläufe zu kontrollieren, Wirkmechanismen zu erforschen und personalisierte Behandlungsstrategien zu entwickeln. Dies ist ein wesentlicher Fortschritt in der modernen Neurotherapie und Forschung.
Molecular Neuroimaging Beispiel 2: Multimodale Bildgebung bei Multipler Sklerose – von der Entzündungsdiagnostik zur Therapieüberwachung
Hintergrund: Heterogenität und Pathophysiologie der Multiplen Sklerose
Multiple Sklerose (MS) ist eine chronisch-entzündliche Autoimmunerkrankung des zentralen Nervensystems (ZNS), die durch eine Kombination aus demyelinisierenden Läsionen und neurodegenerativen Prozessen charakterisiert ist. Aufgrund der heterogenen Krankheitsverläufe, die sich in unterschiedlichen Subtypen wie schubförmig-remittierend (RRMS) und sekundär progredient (SPMS) manifestieren, besteht eine dringende Notwendigkeit für präzise Biomarker zur individuellen Diagnostik, Verlaufsbeurteilung und Therapieoptimierung.
Strukturelle Bildgebung: MRT als Basis der Läsions- und Atrophiebeurteilung
Die Magnetresonanztomographie (MRT) mit T2–gewichteten und FLAIR-Sequenzen ist der Goldstandard zur Detektion von demyelinisierenden Läsionen. Hierbei sind insbesondere neue oder vergrößerte Gadolinium-kontrastmittelaufnehmende Läsionen ein verlässlicher Indikator für aktive Entzündungen und akute Krankheitsaktivität. Studien zeigen, dass bereits das Vorliegen von ≥ 1 neuen Gadolinium-positiven Läsion(en) innerhalb von 6 Monaten eine signifikante Erhöhung des Risikos für klinische Schübe und Langzeitprogression darstellt.
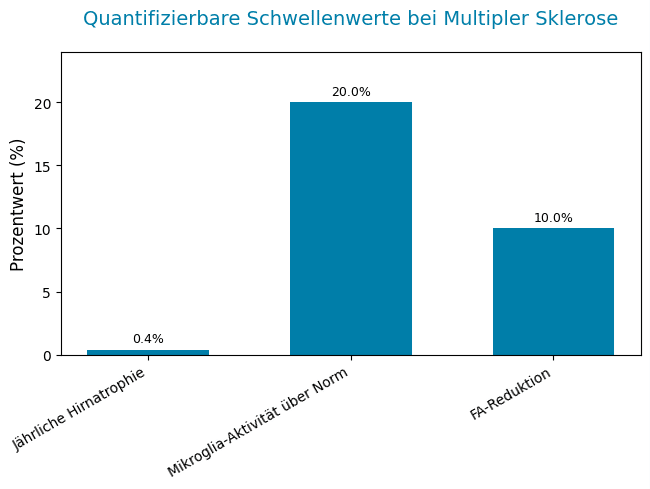
Volumetrische Analysen mittels voxel-basierter Morphometrie (VBM) quantifizieren die Hirnatrophie, wobei insbesondere das Volumen des Thalamus als prädiktiver Marker für kognitive Defizite und Behinderungsprogression gilt. Eine jährliche Atrophierate von > 0,4 % übersteigt die physiologische Hirnalterung und korreliert mit verschlechterter klinischer Prognose.
Molecular Neuroimaging: PET zur Erfassung subklinischer Neuroinflammation
Die Anwendung von PET-Tracern, die an das translocatorische Protein (TSPO) auf aktivierten Mikrogliazellen binden, ermöglicht die Detektion neuroinflammatorischer Prozesse jenseits der klassischen MRT-Läsionserkennung. Ein PET-Signal, das um mehr als 20 % über den alters- und geschlechtskorrigierten Normwerten liegt, identifiziert Patienten mit persistierender Mikroglia-Aktivierung – einem Schlüsselmerkmal des sogenannten „smouldering MS“-Phänotyps. Diese Patientengruppe weist ein deutlich erhöhtes Risiko für klinische und radiologische Progression auf, selbst wenn keine neuen Läsionen im MRT sichtbar sind.
Funktionelle und mikrostrukturelle Bildgebung: fMRT und DTI als Marker für Netzwerk- und Axonalschäden
Resting-State funktionelle MRT (fMRT) zeigt bei MS eine Dysregulation funktioneller Netzwerke. Insbesondere eine Überaktivität im sensorimotorischen Netzwerk wird als kompensatorischer Mechanismus für neuronale Schäden interpretiert. Die Diffusions-Tensor-Bildgebung (DTI) quantifiziert die Mikrostruktur weißer Substanz über die fraktionelle Anisotropie (FA). Ein Rückgang der FA um ≥ 10 % in motorischen Bahnen, z. B. der Pyramidenbahn, korreliert signifikant mit motorischen Ausfällen und Gehbehinderung.
Integrierte Analyse und klinische Konsequenzen
Die Kombination dieser multimodalen Bildgebungsparameter in Machine Learning-Modellen, beispielsweise Random Forest-Algorithmen, ermöglicht eine präzise Prognose des Krankheitsverlaufs. Modelle erreichen Area Under Curve (AUC)-Werte von bis zu 0,90, was eine hohe Sensitivität und Spezifität in der Unterscheidung von stabilen und progredienten Verläufen bedeutet.
Klinische Handlungsschwellen und Therapieempfehlungen
| Biomarker / Bildgebung | Schwellenwert / Kriterium | Klinische Bedeutung | Empfohlene Maßnahme |
| Neue Gadolinium-positive Läsionen (MRT) | ≥ 1 neue Läsion(en) innerhalb 6 Monate | Hinweis auf aktive Entzündung und erhöhtes Schubrisiko | Beginn oder Eskalation einer krankheitsmodifizierenden Therapie (DMT), Kortikosteroidtherapie bei akuten Schüben |
| Hirnatrophierate (Volumetrie) | > 0,4 % jährliche Volumenabnahme | Fortgeschrittene Neurodegeneration, Risiko für kognitive Defizite | Intensivierte klinische Kontrolle, neuropsychologische Tests, Therapieanpassung erwägen |
| Mikroglia-Aktivität (TSPO-PET) | > 20 % über Normsignal | Subklinische, persistierende Neuroinflammation („smouldering MS“) | Frühe Eskalation der Therapie, engmaschiges Monitoring durch Bildgebung und klinische Evaluation |
| Fraktionelle Anisotropie (FA) (DTI) | ≥ 10 % Reduktion in relevanten Bahnen | Axonale Schädigung mit funktionellen Einschränkungen | Ergänzende Rehabilitationsmaßnahmen, Überprüfung und Anpassung der medikamentösen Therapie |
| Machine Learning-basiertes Progressionsrisiko | > 80 % Wahrscheinlichkeit für Krankheitsprogression | Frühe Identifikation von Patienten mit hohem Risiko | Proaktive Therapieoptimierung, engmaschige Verlaufskontrolle |
Ergebnis
Multimodale neuroimaging-basierte Biomarker stellen einen wesentlichen Fortschritt in der individualisierten MS-Diagnostik und -Therapie dar. Die klare Definition von Schwellenwerten ermöglicht eine fundierte Entscheidungsfindung. So kann die Behandlung gezielt eskaliert werden, bevor irreversible neurologische Schäden eintreten, was eine Verbesserung der Lebensqualität und des Langzeitverlaufs der Patientinnen und Patienten begünstigt.
Fazit: Molecular Neuroimaging als Triebkraft der translationalen Neuroscience
Molecular Neuroimaging hat die neurowissenschaftliche Forschung grundlegend transformiert: Von der Grundlagenforschung bis zur klinischen Anwendung liefern bildgebende Verfahren wie PET, 7-Tesla-MRT und DTI einzigartige Einblicke in die Pathophysiologie neurodegenerativer Erkrankungen.
Internationale Forschungsinstitute setzen zunehmend auf multimodale Ansätze und Machine-Learning-Methoden, um präzise Biomarker zu entwickeln, sei es für die Früherkennung von Alzheimer, die Subtypisierung affektiver Störungen wie Depression oder die Therapiesteuerung bei Morbus Parkinson.
Die Zukunft des Molecular Neuroimaging liegt in der Harmonisierung großer multizentrischer Datensätze (z. B. der ADNI-Kohorte) sowie in der Automatisierung durch KI-gestützte Auswertungs-Pipelines.
Mit Novustat setzen Sie diese Innovationen effizient, validiert und datenschutzkonform um, von der voxelbasierten Analyse über klassifikatorische Modelle bis hin zur klinischen Implementierung prädiktiver Bildmerkmale. Für die methodisch fundierte Umsetzung Ihrer Studien im Bereich Molecular Neuroimaging bietet Ihnen Novustat umfassende statistische und analytische Expertise, inklusive: Ziel ist es, die enorme Informationsdichte hochdimensionaler Bilddaten gezielt für Ihre wissenschaftliche und klinische Fragestellungen nutzbar zu machen.