Klinische Studien zum Nachweis von Äquivalenz und Nichtunterlegenheit spielen im Bereich der medizinischen Forschung eine wichtige Rolle zur Bewertung der Wirksamkeit verschiedener Behandlungsmethoden.
Äquivalenz- und Nichtunterlegenheitsstudien sind unverzichtbar, wenn es darum geht, die Wirksamkeit neuer Behandlungen im Vergleich zu bestehenden therapeutischen Optionen zu bewerten. Ihr Ziel besteht darin, zu zeigen, dass eine neue Behandlung mindestens genauso wirksam ist wie eine bestehende Option, ohne zwangsläufig deren Überlegenheit zu beweisen. Dieser Ansatz unterscheidet sich deutlich von Überlegenheitsstudien. Letztere haben das Hauptziel, nachzuweisen, dass eine Behandlung die aktuelle Standardtherapie in Bezug auf Wirksamkeit oder Sicherheit übertrifft.
Aktuelle Zahlen und Entwicklungen klinischer Studien in Europa
In Europa werden jährlich Tausende klinische Studien durchgeführt, die von pharmazeutischen Unternehmen, akademischen Einrichtungen und anderen Organisationen initiiert werden.
Insgesamt listet das EU Clinical Trial Register (EUCTR) mehrere Tausend laufende Studien für ganz Europa, wobei die genauen Zahlen von Jahr zu Jahr variieren. Spanien gilt als eines der studienstärksten Länder in der EU, gefolgt von anderen forschungsintensiven Ländern wie Italien oder Frankreich.
Für Deutschland waren im Jahr 2024 laut dem Deutschen Register Klinischer Studien DRKS etwa 3.355 laufende Studien registriert, was etwa 44 Studien pro eine Million Einwohner entspricht. Im Vergleich dazu verzeichnen kleinere europäische Länder wie Dänemark oder die Niederlande drei- bis fünfmal so viele Studien pro Kopf.
Planen Sie die Durchführung einer klinischen Studie? Novustat begleitet Sie durch alle Schritte Ihres wissenschaftlichen Projekts. Von der Modellierung, über die Datenanalyse bis hin zur Interpretation der Ergebnisse unterstützen wir Sie bei Ihrem Forschungsvorhaben. Unsere Experten aus dem Bereich Biostatistik bieten gerne Medical Writing an, um Ihre wissenschaftlichen Texte mit umfassenden Forschungsergebnissen zu optimieren.
Statistische Tests und Studienarten
Überlegenheitsstudien
Überlegenheitsstudien sind die klassische Form der klinischen Forschung. Sie werden durchgeführt, um zu zeigen, dass eine neue Behandlung einen zusätzlichen Vorteil gegenüber einer Standardtherapie oder einem Placebo bietet. Ziel dieser Studien ist es, signifikante Unterschiede nachzuweisen, die die Überlegenheit der neuen Behandlung belegen. Dabei können Aspekte wie klinische Wirksamkeit, Symptomlinderung oder Sicherheit im Fokus stehen. Ein typisches Beispiel wäre ein Medikament gegen Bluthochdruck. Dieses müsste eine deutlich stärkere Senkung des Blutdrucks im Vergleich zur Standardtherapie erreichen, um als überlegen zu gelten.
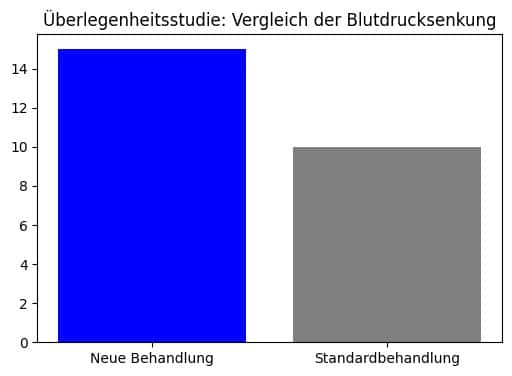
Beispiel Überlegenheitsstudie
Stellen Sie sich vor, ein neues Medikament “CardioPlus” soll mit einem bestehenden blutdrucksenkenden Mittel “StandardMed” verglichen werden. Die Studie wird an 200 Patienten durchgeführt, von denen 100 das neue Medikament und 100 das Standardmedikament erhalten.
Nach sechs Wochen zeigt sich, dass die Patienten mit CardioPlus ihren systolischen Blutdruck im Durchschnitt um 15 mmHg senken konnten, während die Patienten mit StandardMed nur eine Senkung von 10 mmHg erreichten. Die statistische Analyse bestätigt, dass der Unterschied von 5 mmHg signifikant ist. Dieses Ergebnis beweist die Überlegenheit von CardioPlus gegenüber StandardMed.
Äquivalenzstudien
Im Gegensatz dazu suchen Äquivalenzstudien nach Belegen dafür, dass zwei Behandlungen klinisch nicht unterscheidbar sind, wobei eine akzeptable Abweichung von der Wirksamkeit definiert wird. In diesem Fall muss im Voraus festgelegt werden, welche Unterschiede zwischen den Behandlungen klinisch irrelevant sind. Das bedeutet, welcher Spielraum an Abweichungen toleriert wird, ohne die Beurteilung zu beeinflussen, dass beide Behandlungen gleich wirksam sind. Ein typisches Beispiel ist der Vergleich von zwei Formulierungen des gleichen Medikaments. Zum Beispiel ein Generikum und das Originalpräparat, um zu zeigen, dass beide innerhalb vorgegebener Toleranzgrenzen gleichermassen wirksam sind.
Um Äquivalenz nachzuweisen, verwenden diese Studien Konfidenzintervalle und prüfen, ob die Ergebnisse der neuen Behandlung vollständig innerhalb der vorab festgelegten Äquivalenzgrenzen liegen. Wenn das Konfidenzintervall der Differenz in der Wirksamkeit zwischen den Behandlungen innerhalb dieses Rahmens liegt, gilt dies als Beweis dafür, dass die beiden Behandlungen äquivalent sind.
Beispiel Äquivalenzstudie
Ein Generikum namens “GenericBP” wird gegen das Originalmedikament “OriginalBP” getestet, das ebenfalls zur Blutdrucksenkung eingesetzt wird. In der Studie nehmen 150 Patienten das Generikum ein, während weitere 150 Patienten das Originalpräparat erhalten.
Nach acht Wochen beträgt die durchschnittliche Senkung des systolischen Blutdrucks in der Gruppe mit GenericBP 13 mmHg, während die Gruppe mit OriginalBP eine Senkung von 12,5 mmHg zeigt. Die vorher festgelegten Äquivalenzgrenzen liegen bei ±5 mmHg. Da der Unterschied von 0,5 mmHg innerhalb dieser Grenzen liegt, kann die Äquivalenz zwischen den beiden Präparaten nachgewiesen werden.

Nichtunterlegenheitsstudien
Nichtunterlegenheitsstudien zielen darauf ab, zu zeigen, dass eine neue Behandlung nahezu genauso wirksam ist wie die bestehende Referenzbehandlung. Dabei ist es nicht erforderlich, dass die neue Behandlung besser abschneidet. Dieser Studientyp wird häufig eingesetzt, wenn die neue Behandlung zusätzliche Vorteile bietet. Dazu gehören beispielsweise geringere Kosten, weniger Nebenwirkungen oder eine einfachere Verabreichung. Dennoch muss die klinische Wirksamkeit innerhalb eines akzeptablen Rahmens im Vergleich zum Standard bleiben. Ein typisches Beispiel ist der Vergleich eines neuen Antibiotikums mit einem bestehenden. Hierbei soll nachgewiesen werden, dass die Wirksamkeit ähnlich ist, während gleichzeitig weniger Nebenwirkungen zu erwarten sind.
Für diese Art der Untersuchung wird eine Nichtunterlegenheitsgrenze festgelegt: ein Wert, der den maximal akzeptablen Verlust an Wirksamkeit der neuen Behandlung im Vergleich zur Referenzbehandlung darstellt. Wenn das Ergebnis der neuen Behandlung innerhalb dieses Rahmens liegt, wird sie als nicht inferior angesehen.
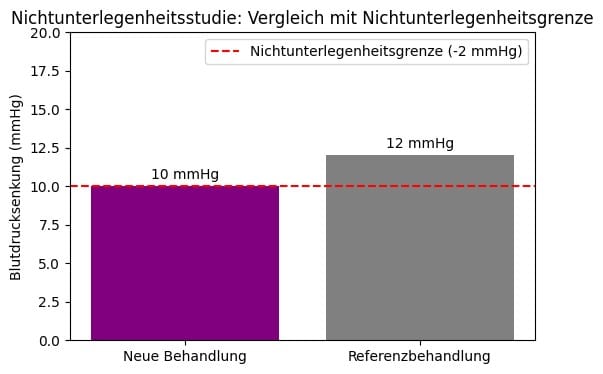
Beispiel Nichtunterlegenheitsstudie
Ein neues Medikament “NeoBP” wird gegen ein etabliertes blutdrucksenkendes Mittel “ClassicBP” getestet. Ziel ist zu zeigen, dass NeoBP in seiner Wirksamkeit nicht schlechter ist, jedoch weniger Nebenwirkungen aufweist.
In der Studie nehmen 120 Patienten NeoBP und 120 Patienten ClassicBP ein. Nach zehn Wochen zeigt NeoBP eine durchschnittliche Blutdrucksenkung von 12 mmHg, während ClassicBP eine Senkung von 13 mmHg erzielt. Die vorher festgelegte Nichtunterlegenheitsgrenze beträgt 2 mmHg. Da der Unterschied von 1 mmHg innerhalb dieser Grenze liegt, wird nachgewiesen, dass NeoBP nicht unterlegen ist. Zusätzliche Auswertungen zeigen, dass NeoBP seltener Nebenwirkungen wie Schwindel verursacht, wodurch das Medikament zusätzliche Vorteile bietet.
Vergleich der Studientypen
| Studientyp | Ziel | Beschreibung | Statistische Methoden |
| Äquivalenzstudie | Vergleichbare Wirksamkeit sicherstellen | Diese Studien zielen darauf ab, zu zeigen, dass zwei Behandlungen (z. B. eine neue und eine bestehende Behandlung) innerhalb eines festgelegten Toleranzbereichs klinisch gleichwertig sind, ohne dass relevante Unterschiede bestehen. | Äquivalenzstudien erfordern die Definition eines „Äquivalenzbereichs“ (z. B. ±10 % der Wirksamkeit der Referenzbehandlung), in dem die neue Behandlung liegen muss. Häufig werden Konfidenzintervalle verwendet, um sicherzustellen, dass die Differenz in diesem Bereich liegt. |
| Nichtunterlegenheitsstudie | Sicherstellen, dass eine Behandlung nicht signifikant schlechter ist, aber andere Vorteile hat | Diese Studien sollen zeigen, dass die neue Behandlung nicht wesentlich weniger wirksam ist als die bestehende Behandlung und dabei möglicherweise Vorteile wie weniger Nebenwirkungen, geringere Kosten oder einfachere Anwendung bietet. | Bei Nichtunterlegenheitsstudien wird ein „Nichtunterlegenheitsbereich“ festgelegt (z. B. eine Differenz von maximal -10 % zur Referenzbehandlung). Statistisch wird geprüft, dass die untere Grenze des Konfidenzintervalls über dieser Nichtunterlegenheitsgrenze liegt. |
| Überlegenheitsstudie | Nachweis einer besseren Wirksamkeit im Vergleich zur Standardbehandlung | Ziel dieser Studien ist es, zu demonstrieren, dass eine neue Behandlung signifikant wirksamer ist als der aktuelle Standard. Sie sollen nicht nur Gleichwertigkeit, sondern eine tatsächliche Verbesserung der Behandlungsergebnisse belegen. | Für Überlegenheitsstudien werden klassische Hypothesentests verwendet, um zu prüfen, ob die neue Behandlung signifikant besser abschneidet. Hier wird ein p-Wert berechnet, der zeigt, ob die Differenz statistisch signifikant ist. |
Wahl des statistischen Tests nach Ergebnistypen
Ein zentraler Punkt bei der Planung von Äquivalenz- und Nichtunterlegenheitsstudien ist danach die Wahl des geeigneten statistischen Tests, der auf das jeweilige Studiendesign Ihrer Forschung abgestimmt ist.
In diesem Zusammenhang ist es aber ebenso wichtig, zwischen den verschiedenen Ergebnistypen zu unterscheiden, die in klinischen Studien verwendet werden. Im Folgenden finden Sie eine Übersicht der Ergebnistypen, sowie eine kostenlose interaktive App zur Kalkulation der Stichprobengrösse in Abhängigkeit des jeweiligen Ergebnistyps.
Kostenloses interaktives Online-Tool zur Berechnung der Stichprobengrösse je nach Ergebnistyps
- Binary Outcome Superiority Trial: Diese Studienart untersucht, ob eine neue Behandlung hinsichtlich eines Ja/Nein-Ergebnisses, z. B. Heilung oder Misserfolg, signifikant besser ist als eine Standardbehandlung.
- Binary Outcome Equivalence Trial: Hier wird geprüft, ob zwei Behandlungen bezüglich eines binären Ergebnisses gleichwertig sind, wobei ein vorab definierter Bereich an tolerierbaren Unterschieden festgelegt wird.
- Binary Outcome Non-Inferiority Trial: Diese Studienart stellt sicher, dass die neue Behandlung nicht signifikant schlechter ist als die Standardbehandlung in Bezug auf ein binäres Ergebnis.
- Continuous Outcome Superiority Trial: Bei dieser Variante wird untersucht, ob eine neue Behandlung hinsichtlich eines kontinuierlichen Ergebnisses, wie z. B. der Blutdruckreduktion, besser ist als die bestehende Therapie.
- Continuous Outcome Equivalence Trial: Hier wird getestet, ob zwei Behandlungen in Bezug auf ein kontinuierliches Mass, z. B. Schmerzreduktion auf einer Skala, als gleichwertig betrachtet werden können.
- Continuous Outcome Non-Inferiority Trial: Diese Studienart prüft, ob eine neue Behandlung nicht signifikant schlechter ist als die Vergleichstherapie bezüglich eines kontinuierlichen Merkmals.
Die Wahl des richtigen Studiendesigns hat dabei direkten Einfluss auf die notwendigen statistischen Tests und die erforderliche Stichprobengrösse. Studien, die auf Äquivalenz oder Nichtunterlegenheit abzielen, benötigen beispielsweise meist grössere Stichproben, um die erforderliche statistische Präzision zu erreichen.
Unsere Statistiker stehen Ihnen bei der Durchführung klinischer Studien gerne zur Seite. Wenn Sie bei Ihren Projekten Unterstützung wünschen, können Sie uns für gerne für ein unverbindliches Beratungsgespräch kontaktieren, um die für Ihr Vorhaben beste Studienkonfiguration zu wählen. Wir würden uns freuen, gemeinsam mit Ihnen an Ihren Forschungsprojekten zu arbeiten!
Spezielle Anforderungen an Äquivalenz- und Nichtunterlegenheitsstudien
Äquivalenz- und Nichtunterlegenheitsstudien erfordern eine spezifische Herangehensweise insbesondereeine detailliertere Interpretation der Daten, da herkömmliche Hypothesentests, die auf signifikante Unterschiede oder Überlegenheit ausgerichtet sind, für die Präzisionsanforderungen dieser Studienarten ungeeignet sind.
Folgende Schritte sind zu beachten:
Definition klinisch irrelevanter Grenzwerte
Um zu zeigen, dass zwei Behandlungen in ihrer Wirksamkeit vergleichbar sind, definieren Forschende vorab, welche Unterschiede als „klinisch irrelevant“ gelten. Dabei legen sie fest, welche Abweichungen toleriert werden können, ohne die Äquivalenz zu gefährden. Äquivalenzstudien prüfen die Gleichwertigkeit in beide Richtungen: Sie untersuchen sowohl eine mögliche Verbesserung der Behandlung als auch eine Verschlechterung. Dabei akzeptieren sie nur minimale Abweichungen, die als klinisch irrelevant eingestuft werden.
Nichtunterlegenheitsstudien hingegen prüfen nur darauf, dass die neue Therapie nicht schlechter ist als ein bestimmter Grenzwert. Sie lassen also auch eine theoretisch höhere Wirksamkeit zu, wenn sie nicht als Ziel definiert ist.
Festlegung von Grenzen: Äquivalenz und Nichtunterlegenheit
Die Festlegung spezifischer Grenzwerte ist damit ein entscheidender Punkt in der Planung von Äquivalenz- und Nichtunterlegenheitsstudien und bestimmt massgeblich deren Design und Interpretation.
Äquivalenzstudien
Bei Äquivalenzstudien mit dem Ziel, die Wirksamkeit zweier Behandlungen als klinisch gleichwertig zu bewerten, legen Forschende einen Äquivalenzbereich fest, innerhalb dessen Abweichungen toleriert werden. Dieser Bereich basiert auf klinischen Erfahrungen und wird im Vorfeld definiert.
Beispiel: Bei der Untersuchung zweier Antihypertensiva könnte eine Abweichung von ±5 mmHg bei der Blutdruckreduktion als irrelevant festgelegt werden, wenn diese Differenz für Patienten keine spürbare Bedeutung hat. Die Äquivalenz wird bestätigt, wenn das Konfidenzintervall der Differenz der durchschnittlichen Therapieeffekte vollständig innerhalb des festgelegten Bereichs bleibt. Weder die untere noch die obere Grenze dürfen diesen Bereich überschreiten.
Nichtunterlegenheitsstudien
In Nichtunterlegenheitsstudien wird überprüft, ob eine neue Behandlung mindestens so wirksam ist wie die Referenztherapie, ohne signifikant schlechter zu sein, weshalb eine Nichtunterlegenheitsgrenze definiert wird, die die maximal tolerierbare Unterlegenheit festlegt.
Ein Beispiel wäre die Einführung eines neuen, kostengünstigeren Antihypertensivums. Wenn als Nichtunterlegenheitsgrenze 5 mmHg festgelegt wird, darf die durchschnittliche Blutdrucksenkung der neuen Behandlung höchstens um 5 mmHg geringer sein als die der etablierten Therapie. In dieser Studienform wird nur die untere Grenze des Konfidenzintervalls betrachtet. Liegt diese oberhalb der Nichtunterlegenheitsgrenze, wird die neue Therapie als nicht unterlegen eingestuft. Ein potenzieller Vorteil gegenüber der Standardtherapie wird zwar zugelassen, steht jedoch nicht im Fokus der Untersuchung.
Unterschiedliche Anforderungen an Präzision und Methodik
Aufgrund der feinen Unterschiede, die diese Studien erfassen sollen, sind präzise statistische Methoden nötig. Bei Äquivalenzstudien müssen die Konfidenzintervalle eng genug sein, um den Äquivalenzbereich vollständig abzudecken. In Nichtunterlegenheitsstudien wird eine ausreichende statistische Power benötigt, um die festgelegte Unterlegenheitsgrenze zuverlässig einzuhalten.
Methoden des Nachweises: Das Konfidenzintervall-Inklusions-Prinzip
Ein bewährtes Verfahren zur Bestätigung von Äquivalenz oder Nichtunterlegenheit ist dabei die Berechnung von Konfidenzintervallen. Die Studie berechnet eine untere und eine obere Grenze für den ausgewählten Parameter und vergleicht diese mit den Äquivalenzgrenzen. Wenn das gesamte Konfidenzintervall innerhalb der festgelegten Äquivalenzgrenzen liegt, bestätigt sich die Hypothese der Äquivalenz.
Für Nichtunterlegenheitsstudien wird in der Regel nur die untere Schranke betrachtet: Sie muss über der vorgegebenen unteren Äquivalenzgrenze liegen.
Fehler in statistischen Tests
Ein häufiger Fehler bei der statistischen Bewertung von Äquivalenz- und Nichtunterlegenheitsstudien ist die fehlerhafte Interpretation eines „negativen Tests“. Tests, die keinen signifikanten Unterschied zwischen zwei Behandlungen zeigen, werden oft fälschlicherweise als Beweis für deren Gleichwertigkeit angesehen.Dies ist ein Missverständnis, da die Abwesenheit eines statistisch signifikanten Unterschieds nicht automatisch bedeutet, dass die Behandlungen tatsächlich gleichwertig sind.
Ein konventioneller statistischer Test, wie ein zweiseitiger Hypothesentest, prüft aktiv, ob ein Unterschied zwischen zwei Gruppen statistisch signifikant ist. Meist setzen Forschende ihn ein, um Überlegenheit oder signifikante Abweichungen nachzuweisen. Findet ein solcher Test keinen signifikanten Unterschied, zeigt das lediglich, dass der beobachtete Unterschied in der aktuellen Stichprobe zu klein ist, um ihn bei der gegebenen Teststärke und dem festgelegten Signifikanzniveau als signifikant zu bewerten. Diese Aussage schliesst aber nicht aus, dass in der Grundgesamtheit oder mit einer grösseren Stichprobe ein relevanter Unterschied bestehen könnte.
Konkreter Unterschied in der Interpretation: Äquivalenz oder Nichtunterlegenheit
Ein „negativer“ zweiseitiger Test sagt also lediglich aus, dass der Unterschied zwischen zwei Behandlungen nicht signifikant ist, nicht jedoch, dass die Behandlungen als gleichwertig anzusehen sind.
Dies ist der entscheidende Punkt: Eine Äquivalenzstudie bestätigt die Gleichwertigkeit erst dann, wenn das gesamte Konfidenzintervall der beobachteten Unterschiede innerhalb des vordefinierten Toleranzbereichs liegt, ohne die Grenzen dieses Bereichs zu überschreiten. Nur spezialisierte Tests, die auf Äquivalenz oder Nichtunterlegenheit ausgerichtet sind, können eine valide Aussage darüber treffen, ob zwei Behandlungen klinisch gleichwertig sind.
Dies ist der entscheidende Punkt: Eine Äquivalenzstudie bestätigt die Gleichwertigkeit erst dann, wenn das gesamte Konfidenzintervall der beobachteten Unterschiede vollständig innerhalb des vordefinierten Toleranzbereichs bleibt. Überschreitet das Intervall diese Grenzen, gilt die Äquivalenz als nicht nachgewiesen. Nur spezialisierte Tests, die gezielt auf Äquivalenz oder Nichtunterlegenheit ausgelegt sind, treffen valide Aussagen über die klinische Gleichwertigkeit zweier Behandlungen.
Beurteilung von Publikationen zu Äquivalenz- und Nichtunterlegenheitsstudien
In wissenschaftlichen Publikationen zu Äquivalenz- und Nichtunterlegenheitsstudien ist Genauigkeit von zentraler Bedeutung. Forschende müssen die verwendeten Äquivalenz- oder Nichtunterlegenheitsgrenzen präzise angeben. Diese Grenzen definieren, welche Unterschiede zwischen den Behandlungen als klinisch unbedeutend oder akzeptabel gelten. Sie bilden den Massstab, an dem die Ergebnisse der Studie gemessen werden. Unklare Angaben oder unsorgfältig ausgewählte statistische Tests können die Aussagekraft der Studienergebnisse erheblich beeinträchtigen. In solchen Fällen droht die Gefahr, falsche Schlussfolgerungen zu ziehen.
Das CONSORT-Addendum für Nichtunterlegenheits- und Äquivalenzstudien bietet Wissenschaftlern daher klare Richtlinien, um sicherzustellen, dass Studienberichte transparente und präzise Informationen liefern. Es empfiehlt spezifische Angaben, darunter die Rationale für die Auswahl der Äquivalenzgrenzen und die ausführliche Darstellung der statistischen Testverfahren. Diese Standards helfen nicht nur, wissenschaftliche Integrität und Nachvollziehbarkeit zu gewährleisten, sondern auch, Fehlinterpretationen der Studienergebnisse zu verhindern und die Glaubwürdigkeit Ihrer Forschung zu stärken.
Herausforderungen und Bedeutung in der klinischen Forschung: Äquivalenz und Nichtunterlegenheit
Die korrekte Planung und Durchführung von Äquivalenz- und Nichtunterlegenheitsstudien sind von massgeblicher Bedeutung, um die Sicherheit und Wirksamkeit neuer Therapien zu belegen. Diese Studien erfordern nicht nur spezifische statistische Verfahren, sondern auch eine sorgfältige Interpretation der Ergebnisse. Insbesondere für den Nachweis der Bioäquivalenz, wie etwa in der Entwicklung von Generika, sind diese Methoden von grundlegender Bedeutung.